Rahasia Mengumpulkan kekayaan lewat Facebook akhirnya
terungkap!! Dapatkan 50ribu-250ribu sehari dengan mudah dan cepat! Mau
tau Rahasianya?? Selengkapnya kunjungi:
klik disini !
Blog yang berisi materi kimia dan umum. Materi kimia seperti: materi unsur hidrogen, gas mulia, boron, selenium, telurium, halogen dsb. Juga berisi materi umum seperti: kata motivasi, kata mutiara, kisah motivasi dsb.

Selamat Datang
Semoga blog ini dapat menambah wawasan dan pengetahuan untuk kita semua.
Rabu, 10 Oktober 2012
Minggu, 12 Februari 2012
Larutan Fehling
Larutan Fehling adalah larutan yang digunakan
untuk membezakan kelompok berfungsi
aldehid atau keton. Bahan
yang ingin diuji akan dipanaskan bersama Larutan Fehling; mendakan merah
menandakan kehadiran aldehid. Keton (kecuali keton hidroksi alfa) tidak
bertindak balas dengannya. Satu contoh ialah penggunaannya ialah untuk
mengesan glukosa
dalam air kencing, lalu membolehkan pengesanan kencing manis. Ia dikembangkan oleh ahli kimia
Jerman Hermann von Fehling. Akan tetapi asid
formik juga memberikan ujian Fehling, bukan sahaja Fehling tetapi juga
Tollen dan banyak lagi tindak balas aldehid.
Larutan Fehling biasanya dibuat sebelum sahaja ujian ingin dijalankan. Ia terdiri daripada jumlah yang sama larutan-larutan berikut:
Ion kuprum(II) dikomplekskan bersama ion tartrat. Hubungan dengan kumpulan aldehid menurunkannya menjadi ion kuprum(I), yang kemudiannya termendak sebagai Cu2O (kuprum(I) oksida) merah.
Penurunan:
Pada masa kini, larutan Fehling biasanya digantikan dengan Larutan Benedict.
Larutan Fehling biasanya dibuat sebelum sahaja ujian ingin dijalankan. Ia terdiri daripada jumlah yang sama larutan-larutan berikut:
- 69.28 gram kuprum(II) sulfat pentahidrat dilarutkan dalam 1 liter air suling
- 346 gram garam Rochelle (kalium natrium tartrat tetrahidrat) dan 120 gram natrium hidroksida dalam 1 liter air suling
Ujian Fehling
Pertama sekali, aldehid dicampurkan dengan larutan Fehling & campuran dipanaskan. Aldehid dioksidakan menjadi asid dan mendakan merah kuprum(I) oksida akan terhasil.Ion kuprum(II) dikomplekskan bersama ion tartrat. Hubungan dengan kumpulan aldehid menurunkannya menjadi ion kuprum(I), yang kemudiannya termendak sebagai Cu2O (kuprum(I) oksida) merah.
Penurunan:
Pada masa kini, larutan Fehling biasanya digantikan dengan Larutan Benedict.
Selasa, 31 Januari 2012
pemerintah kebut studi kelayakan JSS
JAKARTA – Pemerintah menargetkan studi kelayakan
(feasibility study)
megaproyek Jembatan Selat Sunda (JSS) yang akan menghubungkan dua
kawasan strategis, yakni Pulau Jawa dan Sumatera, rampung dalam dua
tahun.
Menteri Pekerjaan Umum (PU) Djoko Kirmanto mengatakan, pemerintah akan segera menandatangani kerja sama pengembangan kawasan strategis dan infrastruktur Selat Sunda dengan konsorsium pemprakarsa. Dia menyebutkan, salah satu pemenang tender pemprakarsa adalah perusahaan milik Tommy Winata. Nantinya, perusahaan tersebut akan bergabung dengan Konsorsium Banten-Lampung yang terdiri dari badan usaha milik daerah (BUMD) di dua provinsi tersebut.
Dalam satu hingga dua hari ini perjanjian kerja sama antara pemerintah dan pemprakarsa diupayakan sudah final. ”Sehingga minggu depan sudah ada penandatanganan antara pemerintah dengan pemrakarsa untuk FS,”ungkap Djoko seusai rapat koordinasi tindak lanjut Perpres No 86/2011 tentang Pembahasan Kawasan Strategis dan Infrastruktur Selat Sunda di Kantor Kementerian bidang Perekonomian, Jakarta,kemarin. Setelah penandatanganan kerja sama antara pemprakarsa dengan pemerintah, secara otomatis proses studi kelayakan dimulai.
Pemerintah dan pihak swasta selaku pemrakarsa telah menentukan waktu penyelesaian studi kelayakan dalam jangka waktu dua tahun sejak dimulai. ”Diberi waktu 24 bulan harus jadi mengenai desain dan anggaran, dan pelaksanaan tender,”tegasnya. Kebutuhan untuk pembangunan proyek kawasan strategis dan infrastruktur Selat Sunda diperkirakan mencapai Rp120 triliun. Perhitungannya, Rp100 triliun untuk pembangunan jembatan dan Rp20 triliun untuk pengembangan kawasan sekitar Jembatan Selat Sunda.
Menyadari besarnya kebutuhan pendanaan untuk realisasi JSS, pemerintah berharap peran serta investor. Menteri Keuangan Agus Martowardojo menambahkan, pembiayaan untuk pembangunan proyek infrastruktur di kawasan Selat Sunda akan dilakukan melalui fasilitas kredit ekspor. ”Ada alternatif negara-negara yang akan bekerja sama dengan kita,”kata Menkeu. wisnoe moerti (sumber:http://www.seputar-indonesia.com/)
Menteri Pekerjaan Umum (PU) Djoko Kirmanto mengatakan, pemerintah akan segera menandatangani kerja sama pengembangan kawasan strategis dan infrastruktur Selat Sunda dengan konsorsium pemprakarsa. Dia menyebutkan, salah satu pemenang tender pemprakarsa adalah perusahaan milik Tommy Winata. Nantinya, perusahaan tersebut akan bergabung dengan Konsorsium Banten-Lampung yang terdiri dari badan usaha milik daerah (BUMD) di dua provinsi tersebut.
Dalam satu hingga dua hari ini perjanjian kerja sama antara pemerintah dan pemprakarsa diupayakan sudah final. ”Sehingga minggu depan sudah ada penandatanganan antara pemerintah dengan pemrakarsa untuk FS,”ungkap Djoko seusai rapat koordinasi tindak lanjut Perpres No 86/2011 tentang Pembahasan Kawasan Strategis dan Infrastruktur Selat Sunda di Kantor Kementerian bidang Perekonomian, Jakarta,kemarin. Setelah penandatanganan kerja sama antara pemprakarsa dengan pemerintah, secara otomatis proses studi kelayakan dimulai.
Pemerintah dan pihak swasta selaku pemrakarsa telah menentukan waktu penyelesaian studi kelayakan dalam jangka waktu dua tahun sejak dimulai. ”Diberi waktu 24 bulan harus jadi mengenai desain dan anggaran, dan pelaksanaan tender,”tegasnya. Kebutuhan untuk pembangunan proyek kawasan strategis dan infrastruktur Selat Sunda diperkirakan mencapai Rp120 triliun. Perhitungannya, Rp100 triliun untuk pembangunan jembatan dan Rp20 triliun untuk pengembangan kawasan sekitar Jembatan Selat Sunda.
Menyadari besarnya kebutuhan pendanaan untuk realisasi JSS, pemerintah berharap peran serta investor. Menteri Keuangan Agus Martowardojo menambahkan, pembiayaan untuk pembangunan proyek infrastruktur di kawasan Selat Sunda akan dilakukan melalui fasilitas kredit ekspor. ”Ada alternatif negara-negara yang akan bekerja sama dengan kita,”kata Menkeu. wisnoe moerti (sumber:http://www.seputar-indonesia.com/)
Rencana pembangunan Jembatan Selat Sunda
Jembatan Selat Sunda
 |
|||
| |||
LOGAM ALKALI
Logam alkali terdiri dr
Litium (Li), Natrium (Na), & rubidium (Rb).
Logam Alkali, Unsur
Gol. I A, mrupakan unsur logam alkali, kcuali
unsur hidrogen yg mrupakan unsur non logam. Unsur-unsur logam
alkali yg merupakan unsur yg elektropositif
dibandingkan dgn unsur-unsur lain yg seperiode, artinya unsur-unsur logam
alkali mudah melepaskan 1 elektron valensi utk mncapai
konfigurasi elektron gas mulia yg lebih stabil & m’bentuk ion
positif.
Definisi Unsur, Senyawa, dan Campuran
Unsur adalah zat murni yang dapat diuraikan lagi
menjadi zat lain yang lebih sederhana dengan reaksi kimia biasa.
Penulisan lambang unsur mengikuti aturan sebagai berikut:
Senyawa mempunyai sifat yang berbeda dengan unsur-unsur pembentuknya. Senyawa hanya dapt diuraikan menjadi unsur-unsur pembentuknya melalui reaksi kimia. Pada kondisi yang sama, senyawa dapat memiliki wujud berbeda dengan unsur-unsur pembentuknya. Sifat fisika dan kimia senyawa berbeda dengan unsur-unsur pembentuknya. Misalnya reaksi antara gas hidrogen dan gas oksigen membentuk senyawa air yang berwujud cair.
Campuran adalah gabungan dari dua zat atau lebih yang hasil penggabungan nya masih mempunyai sifat yang sama dengan zat aslinya. Misalnya, campuran antara air dan gula menghasilkan cairan yang berasa manis.
Campuran dapat berupa gabungan unsur, senyawa, atau keduanya. Campuran Homogen memiliki komposisi maupun wujud yang seragam. Misalnya air gula dan santan. Sebaliknya campuran heterogen memiliki komposisi yang tidak seragam. Misalnya, campuran antara air dan pasir. Campuran dapat dipisahikan menjadi zat-zat penyusun berdasarkan perbedaan sifat zat-zat penyusunnya, misalnya dengan penyaringan.
Penulisan unsur dipermudah dengan adanya lambang unsur. Bagaimana mempermudah penulisan susunan senyawa? Caranya dengan menggunakan rumus kimia, yaitu gabungan lambang unsur sesuai unsur yang menyusun senyawa. Misalnya, lambang unsur natrium adalah Na dan lambang unsur klorin adalah Cl. Jika natrium direaksikan dengan klorin akan menghasilkan senyawa natrium klorida dengan rumus kimia NaCl. Nama umum NaCl ialah garam dapur.(SUMBER:http://syadiashare.com/)
- Lambang unsur diambil dari singkatan nama unsur. Beberapa lambang unsur berasal dari bahasa Latin atau Yunani nama unsur tersebut. Misalnya Fe dari kata ferrum (bahasa latin) sebagai lambang unsur besi.
- Lambang unsur ditulis dengan satu huruf kapital.
- Untuk Unsur yang dilambangkan dengan lebih dengan satu huruf, huruf pertama lambang ditulis dengan huruf kapital dan huruf kedua/ketiga ditulis dengan huruf kecil.
- Unsur-unsur yang memiliki nama dengan huruf pertama sama maka huruf pertama lambang unsur diambil dari huruf pertama nama unsur dan huruf kedua diambil dari huruf lain yang terdapat pada nama unsur tersebut. Misalnya, Ra untuk radium dan Rn untuk radon.
- Unsur Logam: umumnya unsur logam diberi nama akhiran ium. Umumnya logam ini memiliki titik didih tinggi, mengilap, dapat dibengkokan , dan dapt menghantarkan panas atau arus listrik.
- Unsur Non Logam: umumnya memiliki titik didih rendah, tidak mengkilap,kadang-kadang rapuh tak dapat dibengkokkan dan sukar menghantarkan panas atau arus listrik.
Senyawa mempunyai sifat yang berbeda dengan unsur-unsur pembentuknya. Senyawa hanya dapt diuraikan menjadi unsur-unsur pembentuknya melalui reaksi kimia. Pada kondisi yang sama, senyawa dapat memiliki wujud berbeda dengan unsur-unsur pembentuknya. Sifat fisika dan kimia senyawa berbeda dengan unsur-unsur pembentuknya. Misalnya reaksi antara gas hidrogen dan gas oksigen membentuk senyawa air yang berwujud cair.
Campuran adalah gabungan dari dua zat atau lebih yang hasil penggabungan nya masih mempunyai sifat yang sama dengan zat aslinya. Misalnya, campuran antara air dan gula menghasilkan cairan yang berasa manis.
Campuran dapat berupa gabungan unsur, senyawa, atau keduanya. Campuran Homogen memiliki komposisi maupun wujud yang seragam. Misalnya air gula dan santan. Sebaliknya campuran heterogen memiliki komposisi yang tidak seragam. Misalnya, campuran antara air dan pasir. Campuran dapat dipisahikan menjadi zat-zat penyusun berdasarkan perbedaan sifat zat-zat penyusunnya, misalnya dengan penyaringan.
Penulisan unsur dipermudah dengan adanya lambang unsur. Bagaimana mempermudah penulisan susunan senyawa? Caranya dengan menggunakan rumus kimia, yaitu gabungan lambang unsur sesuai unsur yang menyusun senyawa. Misalnya, lambang unsur natrium adalah Na dan lambang unsur klorin adalah Cl. Jika natrium direaksikan dengan klorin akan menghasilkan senyawa natrium klorida dengan rumus kimia NaCl. Nama umum NaCl ialah garam dapur.(SUMBER:http://syadiashare.com/)
Sabtu, 21 Januari 2012
TATA NAMA SENYAWA POLIATOMIK & ASAM BASA
TATA NAMA SENYAWA POLIATOMIK & ASAM BASA
Berikut ini nama-nama beberapa senyawa poliatomik.
| Rumus Ion | Nama Senyawa | Rumus Ion | Nama Senyawa |
| NH4+ | Amonium | PO32- | Fospit |
| OH- | Hidroksida | PO43- | Fosfat |
| CN- | Sianida | AsO3- | Arsenit |
| CH3COO- | Asetat | AsO43- | Arsenat |
| CO32- | Karbonat | ClO- | Klorit |
| HCO3- | Bikarbonat | ClO2- | Klorat |
| SiO32- | Silikat | ClO4- | Perklorat |
| NO2- | Nitrit | MnO4- | Permanganat |
| NO3- | Nitrat | MnO42- | Manganat |
| SO32- | Sulfit | CrO42- | Kromat |
| SO42- | Sulfat | Cr2O72- | Dikromat |
- Untuk senyawa yang terdiri dari kation logam dan anion poliatom, maka penamaan dimulai dari nama kation logam diikuti anion poliatom. Contoh :
|
Rumus
Kimia
|
Kation
|
Anion
|
Nama
Senyawa
|
| NaOH | Na+ | OH- | Natrium hidroksida |
| KMnO4 | K+ | MnO4- | Kalium permanganat |
- Untuk senyawa yang terdiri dari kation poliatom dan anion monoatom/poliatom, maka penamaan dimulai dari nama kation monoatom/poliatom. Contoh :
NH4Cl = amonium klorida
TUGAS/DISKUSI
Tentukan nama dari senyawa poliatom berikut :
- 1. NaClO2 b) Na3PO4 c) Na2SO3
- Anion-anion poliatom lebih banyak dibandingkan kation poliatom
- Oksigen dapat membentuk banyak anion poliatom yang disebut anion okso.
- Unsur-unsur logam tertentu seperti Cl, N, P, dan S dapat membentuk suatu seri anion okso yang mengandung beberapa atom oksigen. Penamaan berdasarkan tingkat oksidasi dari atom-atom yang mengikat oksigen
- Untuk tingkat oksidasi oksigen yang terkecil disebut hipo, dan yang paling tinggi disebut per.
- Semua anion okso dari Cl, Br, dan I memiliki muatan -1
- Beberapa anion okso yang mengandung sejumlah atom H, penamaannya disesuaikan misalnya H2PO42- (ion hidrogen fospat) dan H2PO4- (ion dihidrogen fospat)
- Awalan tio berarti bahwa satu atom sulfur telah ditambahkan untuk menggantikan satu atom oksigen (ion sulfat (SO4) memiliki satu atom S dan empat atom O; ion tiosulfat memiliki dua atom S dan 3 atom O (S2O3)
- (SUMBER:http://esdikimia.wordpress.com/2011/05/04/tata-nama-senyawa-poliatomik-asam-basa/)
0.000000
0.000000
LARUTAN PENYANGGA
LARUTAN PENYANGGA
i
2 Votes
Larutan penyangga yang bersifat asam
Larutan penyangga yang bersifat asam adalah sesuatu yang memiliki pH kurang dari 7. Larutan penyangga yang bersifat asam biasanya terbuat dari asam lemah dan garammya – acapkali garam natrium.Contoh yang biasa merupakan campuran asam etanoat dan natrium etanoat dalam larutan. Pada kasus ini, jika larutan mengandung konsentrasi molar yang sebanding antara asam dan garam, maka campuran tersebut akan memiliki pH 4.76. Ini bukan suatu masalah dalam hal konsentrasinya, sepanjang keduanya memiliki konsentrasi yang sama.
Anda dapat mengubah pH larutan penyangga dengan mengubah rasio asam terhadap garam, atau dengan memilih asam yang berbeda dan salah satu garamnya.
Larutan penyangga yang bersifat basa
larutan penyangga yang bersifat basa memiliki pH diatas 7. Larutan penyangga yang bersifat basa biasanya terbuat dari basa lemah dan garamnya.Seringkali yang digunakan sebagai contoh adalah campuran larutan amonia dan larutan amonium klorida. Jika keduanya dalam keadaan perbandingan molar yang sebanding, larutan akan memiliki pH 9.25. Sekali lagi, hal itu bukanlah suatu masalah selama konsentrasi yang anda pilih keduanya sama.
Bagaimana cara larutan penyangga bekerja?
Larutan penyangga mengandung sesuatu yang akan menghilangkan ion hidrogen atau ion hidroksida yang mana anda mungkin menambahkannya – sebaliknya akan merubah pH. Larutan penyangga yang bersifat asam dan basa mencapai kondisi ini melalui cara yang berbeda.Larutan penyangga yang bersifat asam
Kita akan mengambil campuran asam etanoat dan natrium etanoat sebagai contoh yang khas.Asam etanoat adalah asam lemah, dan posisi kesetimbangan akan bergeser ke arah kiri:
Penambahan natrium etanoat pada kondisi ini menambah kelebihan ion etanoat dalam jumlah yang banyak. Berdasarkan Prinsip Le Chatelier, ujung posisi kesetimbangan selanjutnya bergeser ke arah kiri.
Karena itu larutan akan mengandung sesuatu hal yang penting:
- Banyak asam etanoat yang tidak terionisasi;
- Banyak ion etanoat dari natrium etanoat:
- Cukup ion hidrogen untuk membuat larutan menjadi bersifat asam.
Penambahan asam pada larutan penyangga yang bersifat asam
Larutan penyangga harus menghilangkan sebagian besar ion hidrogen yang baru sebaliknya pH akan turun dengan mencolok sekali.Ion hidrogen bergabung dengan ion etanoat untuk menghasilkan asam etanoat. Meskipun reaksi berlangsung reversibel, karena asam etanoat adalah asam lemah, sebagaian besar ion hidrogen yang baru dihilangkan melalui cara ini.
Karena sebagian besar ion hidrogen yang baru dihilangkan, pH tidak akan berubah terlalu banyak – tetapi karena kesetimbangan ikut terlibat, pH akan sedikit menurun.
Penambahan basa pada larutan penyangga yang bersifat asam
Larutan basa mengandung ion hidroksida dan larutan penyangga menghilangkan ion hidroksida tersebut.Kali ini situasinya sedikit lebih rumit karena terdapat dua proses yang dapat menghilangkan ion hidroksida.
Penghilangan ion hidroksida melalui reaksi dengan asam etanoat
Sebagian besar zat yang bersifat asam yang mana ion hidroksida bertumbukan dengan molekul asam etanoat. Keduanya akan bereaksi untuk membentuk ion etanoat dan air.
Karena sebagian besar ion hidroksida dihilangkan, pH tidak berubah terlalu besar.
Penghilangan ion hidroksida melalui reaksi dengan ion hidrogen
Harus diingat bahwa beberapa ion hidrogen yang ada berasal dari ionisasi asam aetanoat.Ion hidroksida dapat bergabung dengannya untuk membentuk air. Selama hal itu terjadi, ujung kesetimbangan menggantikannya. Hal ini tetap terjadi sampai sebagian besar ion hidrogen dihilangkan.

Sekali lagi, karena anda memiliki kesetimbangan yang terlibat, tidak semua ion hidroksida dihilangkan – karena terlalu banyak. Air yang terbentuk terionisasi kembali menjadi tingat yang sangat kecil untuk memberikan beberapa ion hidrogen dan ion hidroksida.
Larutan penyangga yang bersifat basa
Kita akan menganbil campuran larutan amonia dan amonium klorida sebagai contoh yang khas.Amonia adalah basa lemah, dan posisi kesetimbangan akan bergerak ke arah kiri:
Penambahan amonium klorida pada kondisi ini menambahkan kelebihan ion amonium dalam jumlah yang banyak. Berdasarkan Prinsip Le Chatelier, hal itu akan menyebabkan ujung posisi kesetimbangan akan bergeser ke arah kiri.
Karena itu larutan akan mengandung beberapa hal yang penting:
- Banyak amonia yang tidak bereaksi;
- Banyak ion amonia dari amonium klorida;
- Cukup ion hidrogen untuk menghasilkan larutan yang bersifat basa.
Penambahan asam pada larutan penyangga yang bersifat basa
Terdapat dua proses yang dapat menghilangkan ion hidrogen yang anda tambahkan.Penghilangan ion hidrogen melalui reaksi dengan amonia
Sebagian besar zat dasar yang mana ion hidrogen bertumbukan dengannya adalah molekul amonia. Keduanya akan bereaksi untuk membentuk ion amonium.
Sebagian besar, tetapi tidak seluruhnya, ion hidrogen akan dihilangkan. Ion amonium bersifat asam yang sedikit lemah, dan karena itu ion hidrohen akan dilepaskan kembali.
Penghilangan ion hidrogen melalui reaksi dengan ion hidroksida
Harus diingat bahwa beberepa ion hidroksida yang ada berasal dari reaksi antara amonia dan air.Ion hidrogen dapat bergabung dengan ion hidroksida tersebut untuk menghasilkan air. Selama hal itu terjadi, ujung kesetimbangan menggantikan ion hidroksida. Hal ini terus terjadi sampai sebagian besar ion hidrogen dihilangkan.

Sekali lagi, karena anda memiliki kesetimbangan yang terlibat, tidak semua ion hidrogen dihilangkan – hanya sebagian besar.
Penambahan basa pada larutan penyangga yang bersifat basa
Ion hidroksida dari alkali dihilangkan melali reaksi yang sederhana dengan ion amonium.Karena amonia yang terbentuk merupakan basa lemah, amonia akan bereaksi dengan air – dan karena itu reaksi sedikit reversibel. Hal ini berarti bahwa, sekali lagi, sebagian besar (tetapi tidak semuanya) ion hidrogen dihilangkan dari larutan.(SUMBER:http://esdikimia.wordpress.com/2011/06/17/larutan-penyangga/)
LARUTAN PENYANGGA
LARUTAN PENYANGGA
SEL ELEKTROLISIS
SEL ELEKTROLISIS
Sel
Elektrolisis adalah sel yang menggunakan arus listrik untuk
menghasilkan reaksi redoks yang diinginkan dan digunakan secara luas di
dalam masyarakat kita. Baterai aki yang dapat diisi ulang merupakan
salah satu contoh aplikasi sel elektrolisis dalam kehidupan sehari-hari.
Baterai aki yang sedang diisi kembali (recharge) mengubah
energi listrik yang diberikan menjadi produk berupa bahan kimia yang
diinginkan. Air, H2O, dapat diuraikan dengan menggunakan
listrik dalam sel elektrolisis. Proses ini akan mengurai air menjadi
unsur-unsur pembentuknya. Reaksi yang terjadi adalah sebagai berikut :
2 H2O(l) ——> 2 H2(g) + O2(g)
Rangkaian sel elektrolisis hampir
menyerupai sel volta. Yang membedakan sel
elektrolisis dari sel volta adalah, pada sel
elektrolisis, komponen voltmeter diganti
dengan sumber arus (umumnya baterai). Larutan atau
lelehan yang ingin dielektrolisis, ditempatkan dalam suatu wadah.
Selanjutnya, elektroda dicelupkan ke dalam larutan maupun lelehan
elektrolit yang ingin dielektrolisis. Elektroda yang digunakan umumnya
merupakan elektroda inert, seperti Grafit (C), Platina (Pt), dan Emas
(Au). Elektroda berperan sebagai tempat berlangsungnya reaksi. Reaksi reduksi
berlangsung di katoda, sedangkan reaksi oksidasi
berlangsung di anoda. Kutub negatif
sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub
positif sumber arus tentunya mengarah pada anoda. Akibatnya, katoda
bermuatan negatif dan menarik kation-kation
yang akan tereduksi menjadi endapan logam. Sebaliknya, anoda
bermuatan positif dan menarik anion-anion yang
akan teroksidasi menjadi gas. Terlihat jelas bahwa
tujuan elektrolisis adalah untuk mendapatkan endapan logam di katoda dan
gas di anoda.
Ada dua tipe elektrolisis, yaitu elektrolisis
lelehan (leburan) dan elektrolisis larutan.
Pada proses elektrolisis lelehan, kation pasti
tereduksi di katoda dan anion pasti teroksidasi di anoda. Sebagai
contoh, berikut ini adalah reaksi elektrolisis lelehan garam NaCl (yang
dikenal dengan istilah sel Downs) :
Katoda (-) : 2 Na+(l)
+ 2 e- ——> 2 Na(s) ……………….. (1)
Anoda (+) : 2 Cl-(l)
Cl2(g) + 2 e- ……………….. (2)
Reaksi sel : 2 Na+(l)
+ 2 Cl-(l) ——> 2 Na(s) +
Cl2(g) ……………….. [(1) + (2)]
Reaksi elektrolisis lelehan
garam NaCl menghasilkan endapan logam natrium di katoda dan
gelembung gas Cl2 di anoda. Bagaimana halnya jika lelehan
garam NaCl diganti dengan larutan garam NaCl?
Apakah proses yang terjadi masih sama? Untuk mempelajari reaksi elektrolisis
larutan garam NaCl, kita mengingat kembali Deret Volta
(lihat Elektrokimia I : Penyetaraan Reaksi Redoks dan Sel
Volta).
Pada katoda, terjadi
persaingan antara air dengan ion Na+. Berdasarkan Tabel
Potensial Standar Reduksi, air memiliki E°red yang
lebih besar dibandingkan ion Na+. Ini berarti, air lebih
mudah tereduksi dibandingkan ion Na+. Oleh
sebab itu, spesi yang bereaksi di katoda adalah air.
Sementara, berdasarkan Tabel Potensial Standar Reduksi,
nilai E°red ion Cl- dan air
hampir sama. Oleh karena oksidasi air memerlukan potensial tambahan (overvoltage),
maka oksidasi ion Cl- lebih mudah dibandingkan
oksidasi air. Oleh sebab itu, spesi yang bereaksi di anoda
adalah ion Cl-. Dengan demikian, reaksi yang
terjadi pada elektrolisis larutan garam NaCl adalah
sebagai berikut :
Katoda (-) : 2 H2O(l)
+ 2 e- ——> H2(g) + 2 OH-(aq)
……………….. (1)
Anoda (+) : 2 Cl-(aq)
——> Cl2(g) + 2 e- ……………….. (2)
Reaksi sel : 2 H2O(l)
+ 2 Cl-(aq) ——> H2(g) +
Cl2(g) + 2 OH-(aq) ……………………. [(1) +
(2)]
Reaksi elektrolisis larutan
garam NaCl menghasilkan gelembung gas H2 dan ion OH‑
(basa) di katoda serta gelembung gas Cl2 di anoda.
Terbentuknya ion OH- pada katoda dapat dibuktikan dengan
perubahan warna larutan dari bening menjadi merah muda setelah diberi
sejumlah indikator fenolftalein (pp). Dengan demikian, terlihat bahwa
produk elektrolisis lelehan umumnya berbeda dengan produk elektrolisis
larutan.
Selanjutnya kita mencoba mempelajari
elektrolisis larutan Na2SO4. Pada katoda,
terjadi persaingan antara air dan ion Na+. Berdasarakan
nilai E°red, maka air yang akan tereduksi
di katoda. Di lain sisi, terjadi persaingan
antara ion SO42- dengan air di anoda.
Oleh karena bilangan oksidasi S pada SO4-2
telah mencapai keadaan maksimumnya, yaitu +6, maka spesi SO42-
tidak dapat mengalami oksidasi. Akibatnya, spesi air yang akan teroksidasi
di anoda. Reaksi yang terjadi adalah sebagai
berikut :
Katoda (-) : 4 H2O(l)
+ 4 e- ——> 2 H2(g) + 4 OH-(aq)
……………….. (1)
Anoda (+) : 2 H2O(l)
——> O2(g) + 4 H+(aq) + 4
e- ……………….. (2)
Reaksi sel : 6 H2O(l) ——>
2 H2(g) + O2(g) + 4 H+(aq) +
4 OH-(aq) …………………….. [(1) + (2)]
6 H2O(l) ——>
2 H2(g) + O2(g) + 4 H2O(l) ………………….
[(1) + (2)]
2 H2O(l) ——> 2
H2(g) + O2(g) …………………….. [(1) + (2)]
Dengan demikian, baik ion Na+ maupun
SO42-, tidak bereaksi. Yang terjadi justru adalah
peristiwa elektrolisis air menjadi unsur-unsur pembentuknya. Hal yang
serupa juga ditemukan pada proses elektrolisis larutan Mg(NO3)2
dan K2SO4.
Bagaimana halnya jika elektrolisis
lelehan maupun larutan menggunakan elektroda yang tidak inert, seperti
Ni, Fe, dan Zn? Ternyata, elektroda yang tidak inert hanya dapat
bereaksi di anoda, sehingga produk yang dihasilkan di anoda
adalah ion elektroda yang larut (sebab logam yang tidak
inert mudah teroksidasi). Sementara, jenis elektroda tidak
mempengaruhi produk yang dihasilkan di katoda. Sebagai
contoh, berikut adalah proses elektrolisis larutan garam NaCl dengan
menggunakan elektroda Cu :
Katoda (-) : 2 H2O(l)
+ 2 e- ——> H2(g) + 2 OH-(aq)
…………………….. (1)
Anoda (+) : Cu(s)
——> Cu2+(aq) + 2 e- ……………………..
(2)
Reaksi sel : Cu(s)
+ 2 H2O(l) ——> Cu2+(aq) +
H2(g) + 2 OH-(aq) ……………………..
[(1) + (2)]
Dari pembahasan di atas, kita dapat
menarik beberapa kesimpulan yang berkaitan dengan reaksi elektrolisis :
- Baik elektrolisis lelehan maupun larutan, elektroda inert tidak akan bereaksi; elektroda tidak inert hanya dapat bereaksi di anoda
- Pada elektrolisis lelehan, kation pasti bereaksi di katoda dan anion pasti bereaksi di anoda
- Pada elektrolisis larutan, bila larutan mengandung ion alkali, alkali tanah, ion aluminium, maupun ion mangan (II), maka air yang mengalami reduksi di katoda
- Pada elektrolisis larutan, bila larutan mengandung ion sulfat, nitrat, dan ion sisa asam oksi, maka air yang mengalami oksidasi di anoda
Salah satu aplikasi sel elektrolisis
adalah pada proses yang disebut penyepuhan. Dalam
proses penyepuhan, logam yang lebih mahal dilapiskan
(diendapkan sebagai lapisan tipis) pada permukaan logam yang lebih murah
dengan cara elektrolisis. Baterai umumnya digunakan sebagai sumber
listrik selama proses penyepuhan berlangsung. Logam
yang ingin disepuh berfungsi sebagai katoda dan lempeng
perak (logam pelapis) yang merupakan logam penyepuh berfungsi sebagai anoda.
Larutan elektrolit yang digunakan harus mengandung spesi ion logam yang
sama dengan logam penyepuh (dalam hal ini, ion perak). Pada proses
elektrolisis, lempeng perak di anoda akan teroksidasi dan larut menjadi
ion perak. Ion perak tersebut kemudian akan diendapkan sebagai lapisan
tipis pada permukaan katoda. Metode ini relatif mudah dan tanpa biaya
yang mahal, sehingga banyak digunakan pada industri perabot rumah tangga
dan peralatan dapur.
Setelah kita mempelajari aspek
kualitatif reaksi elektrolisis, kini kita akan melanjutkan dengan aspek
kuantitatif sel elektrolisis. Seperti yang telah disebutkan di awal,
tujuan utama elektrolisis adalah untuk mengendapkan logam dan
mengumpulkan gas dari larutan yang dielektrolisis. Kita dapat menentukan
kuantitas produk yang terbentuk melalui konsep mol dan stoikiometri.
Satuan yang sering ditemukan dalam aspek
kuantitatif sel elektrolisis adalah Faraday (F). Faraday didefinisikan
sebagai muatan (dalam Coulomb) mol elektron. Satu Faraday equivalen
dengan satu mol elektron. Demikian halnya, setengah Faraday equivalen
dengan setengah mol elektron. Sebagaimana yang telah kita ketahui,
setiap satu mol partikel mengandung 6,02 x 1023partikel.
Sementara setiap elektron mengemban muatan sebesar 1,6 x 10-19 C.
Dengan demikian :
1 Faraday = 1 mol elektron = 6,02 x
1023 partikel elektron x 1,6 x 10-19 C/partikel
elektron 1 Faraday = 96320 C (sering dibulatkan menjadi 96500 C untuk
mempermudah perhitungan)
Hubungan antara Faraday dan Coulomb
dapat dinyatakan dalam persamaan berikut :
Faraday = Coulomb / 96500
Coulomb = Faraday x 96500
Coulomb adalah satuan muatan listrik.
Coulomb dapat diperoleh melalui perkalian arus listrik (Ampere) dengan
waktu (detik). Persamaan yang menunjukkan hubungan Coulomb, Ampere, dan
detik adalah sebagai berikut :
Coulomb = Ampere x Detik
Q = I x t
Dengan demikian, hubungan antara
Faraday, Ampere, dan detik adalah sebagai berikut :
Faraday = (Ampere x Detik) / 96500
Faraday = (I x t) / 96500
Dengan mengetahui besarnya Faraday pada
reaksi elektrolisis, maka mol elektron yang dibutuhkan pada reaksi
elektrolisis dapat ditentukan. Selanjutnya, dengan memanfaatkan
koefisien reaksi pada masing-masing setengah reaksi di katoda
dan anoda, kuantitas produk elektrolisis dapat ditemukan.
Berikut ini adalah beberapa contoh soal
aspek kuantitatif sel elektrolisis :
1. Pada elektrolisis larutan AgNO3 dengan
elektroda inert dihasilkan gas oksigen sebanyak 5,6 L pada STP.
Berapakah jumlah listrik dalam Coulomb yang dialirkan pada proses
tersebut?
Penyelesaian :
Reaksi elektrolisis larutan AgNO3 dengan
elektroda inert adalah sebagai berikut :
Katoda (-) : Ag+ + e-
——> Ag
Anoda (+) : 2 H2O(l)
——> O2(g) + 4 H+(aq) + 4 e-
Gas O2 terbentuk di anoda.
Mol gas O2 yang terbentuk sama dengan 5,6 L / 22,4 L = ¼ mol
O2
Berdasarkan persamaan reaksi di anoda,
untuk menghasilkan ¼ mol gas O2, maka jumlah mol elektron
yang terlibat adalah sebesar 4 x ¼ = 1 mol elektron.
1 mol elektron = 1 Faraday = 96500 C
Jadi, jumlah listrik yang terlibat
adalah sebesar 96500 C
2. Unsur Fluor dapat diperoleh dengan
cara elektrolisis lelehan NaF. Berapakah waktu yang diperlukan untuk
mendapatkan 15 L gas fluorin ( 1 mol gas mengandung 25 L gas) dengan
arus sebesar 10 Ampere?
Penyeleasian :
Reaksi elektrolisis lelehan NaF adalah
sebagai berikut :
K (-) : Na+(l) + e-
——> Na(s)
A (-) : 2 F-(l)
——> F2(g) + 2 e-
Gas F2 terbentuk di anoda.
Mol gas F2 yang terbentuk adalah sebesar 15 L / 25 L = 0,6
mol F2
Berdasarkan persamaan reaksi di anoda,
untuk menghasilkan 0,6 mol gas F2, akan melibatkan mol
elektron sebanyak 2 x 0,6 = 1,2 mol elektron
1,2 mol elektron = 1,2 Faraday
Waktu yang diperlukan dapat dihitung
melalui persamaan berikut :
Faraday = (Ampere x Detik) / 96500
1,2 = (10 x t) / 96500
t = 11850 detik = 3,22 jam
Jadi, diperlukan waktu selama 3,22 jam
untuk menghasilkan 15 L gas fluorin
3. Arus sebesar 0,452 A dilewatkan pada
sel elektrolisis yang mengandung lelehan CaCl2 selama 1,5
jam. Berapakah jumlah produk yang dihasilkan pada masing-masing
elektroda?
Penyelesaian :
Reaksi elektrolisis lelehan CaCl2
adalah sebagai berikut :
K (-) : Ca2+(l)
+ 2 e- ——> Ca(s)
A (+) : 2 Cl-(l)
——> Cl2(g) + 2 e-
Mol elektron yang terlibat dalam reaksi
ini dapat dihitung dengan persamaan berikut :
Faraday = (Ampere x Detik) / 96500
Faraday = (0,452 x 1,5 x 3600) /
96500 mol elektron
Berdasarkan persamaan reaksi di katoda,
mol Ca yang dihasilkan adalah setengah dari mol elektron yang terlibat.
Dengan demikian, massa Ca yang dihasilkan adalah :
Massa Ca = mol Ca x Ar Ca
Massa Ca = ½ x (0,452 x 1,5 x
3600) / 96500 x 40 = 0,506 gram Ca
Berdasarkan persamaan reaksi di anoda,
mol gas Cl2 yang dihasilkan adalah setengah dari
mol elektron yang terlibat. Dengan demikian, volume gas Cl2 (STP)
yang dihasilkan adalah :
Volume gas Cl2 = mol Cl2
x 22,4 L
Volume gas Cl2 = ½ x
(0,452 x 1,5 x 3600) / 96500 x 22.4 L = 0,283 L gas Cl2
Jadi, produk yang dihasilkan di katoda
adalah 0,506 gram endapan Ca dan produk yang dihasilkan di anoda adalah
0,283 L gas Cl2 (STP)
4. Dalam sebuah percobaan elektrolisis,
digunakan dua sel yang dirangkaikan secara seri. Masing-masing sel
menerima arus listrik yang sama. Sel pertama berisi larutan AgNO3,
sedangkan sel kedua berisi larutan XCl3. Jika setelah
elektrolisis selesai, diperoleh 1,44 gram logam Ag pada sel pertama dan
0,12 gram logam X pada sel kedua, tentukanlah massa molar (Ar) logam X
tersebut!
Penyelesaian :
Reaksi elektrolisis larutan AgNO3
:
K (-) : Ag+(aq) +
e- ——> Ag(s)
A (+) : 2 H2O(l)
——> O2(g) + 4 H+(aq) + 4 e-
Logam Ag yang dihasilkan sebanyak 1,44
gram; dengan demikian, mol logam Ag yang dihasilkan sebesar 1,44 / 108
mol Ag
Berdasarkan persamaan reaksi di katoda,
mol elektron yang dibutuhkan untuk menghasilkan logam Ag sama dengan
mol logam Ag (koefisien reaksinya sama)
Sehingga, mol elektron yang digunakan
dalam proses elektrolisis ini adalah sebesar 1,44 / 108 mol elektron
Reaksi elektrolisis larutan XCl3 :
K (-) : X3+(aq) +
3 e- ——> X(s)
A (+) : 2 Cl-(l) ——>
Cl2(g) + 2 e-
Arus yang sama dialirkan pada sel kedua,
sehingga, mol elektron yang digunakan dalam proses elektrolisis ini
sama seperti sebelumya, yaitu sebesar 1,44 / 108 mol elektron
Berdasarkan persamaan reaksi di katoda,
mol logam X yang dihasilkan sama dengan 1 / 3 kali mol elektron, yaitu
sebesar 1 / 3 x 1,44 / 108 mol X
Massa logam X = 0,12 gram; dengan
demikian, massa molar (Ar) logam X adalah sebagai berikut:
mol = massa / Ar
Ar = massa / mol
Ar = 0,12 / (1 / 3 x 1,44 / 108)
= 27
Jadi, Ar dari logam X adalah 27
(SUMBER:http://esdikimia.wordpress.com/2011/09/28/sel-elektrolisis/)
0.000000
0.000000
PENDANAAN : DPRD Lamteng Usulkan Peningkatan Infrastruktur PDF Print E-mail User Rating: / 0 PoorBest Senin, 21 November 2011 05:09 GUNUNGSUGIH (Lampost): DPRD Lampung Tengah mengusulkan anggaran bagi pembangunan infrastruktur tahun anggaran (TA) 2012 ditingkatkan. Pasalnya, bidang tersebut masih menjadi masalah utama di daerah ini. "Dari hasil reses kami di daerah pemilihan (dapil) IV, yang mencakup Kecamatan Anak Tuha, Padangratu, Pubian, Selanggai, dan Anak Ratuaji, umumnya warga meminta perbaikan infrastruktur," kata Kaswan Sanusi, ketua Komisi I DPRD, kemarin (20-11). Kaswan mengatakan sejauh ini Komisi I DPRD belum mendengar kabar terkait dengan RAPBD untuk 2012. Pihaknya juga berharap sektor pertanian mendapat perhatian berikutnya, karena Lampung Tengah termasuk salah satu lumbung pertanian di Lampung. Sementara Ketua Komisi III Bambang Suryadi juga mengatakan hal sama. Selain peningkatan anggaran untuk infrastruktur, sektor lain juga harus diperhatikan. Tak kalah penting bidang pengawasan. "Anggaran besar tanpa pengawasan akan menurunkan kualitas. Sedangkan pemerintah mengeluarkan dana banyak untuk pemeliharaan," ujarnya. Pemerintah Lamteng berencana menaikkan anggaran infrastruktur 20% pada APBD 2012. Ini didasarkan atas rencana pendapatan yang meningkat Rp200 miliar dari Rp1,2 triliun menjadi Rp1,4 triliun dalam RAPBD 2012. Sebelumnya, sebagaimana diketahui, selama satu tahun kepemimpinannya, Bupati A. Pairin menjelaskan pihaknya telah membangun jalan onderlaag sepanjang 21,97 km. Selain itu, juga peningkatan jalan sepanjang 159,96 km dan pemeliharan jalan sepanjang 72,80 km. "Pemkab Lampung Tengah juga telah membangun 11 jembatan, talut sepanjang 485.92 M, 11 gorong-gorong, rehabilitasi, serta pemeliharaan sarana-prasarana irigasi," ujar Pairin. (LUT/D-1)
| PENDANAAN : DPRD Lamteng Usulkan Peningkatan Infrastruktur |
 |
 |
 |
| Senin, 21 November 2011 05:09 |
|
GUNUNGSUGIH
(Lampost): DPRD Lampung Tengah mengusulkan anggaran bagi pembangunan
infrastruktur tahun anggaran (TA) 2012 ditingkatkan. Pasalnya, bidang
tersebut masih menjadi masalah utama di daerah ini.
"Dari
hasil reses kami di daerah pemilihan (dapil) IV, yang mencakup Kecamatan
Anak Tuha, Padangratu, Pubian, Selanggai, dan Anak Ratuaji, umumnya
warga meminta perbaikan infrastruktur," kata Kaswan Sanusi, ketua Komisi
I DPRD, kemarin (20-11).
Kaswan
mengatakan sejauh ini Komisi I DPRD belum mendengar kabar terkait dengan
RAPBD untuk 2012. Pihaknya juga berharap sektor pertanian mendapat
perhatian berikutnya, karena Lampung Tengah termasuk salah satu lumbung
pertanian di Lampung.
Sementara
Ketua Komisi III Bambang Suryadi juga mengatakan hal sama. Selain
peningkatan anggaran untuk infrastruktur, sektor lain juga harus
diperhatikan. Tak kalah penting bidang pengawasan. "Anggaran besar tanpa
pengawasan akan menurunkan kualitas. Sedangkan pemerintah mengeluarkan
dana banyak untuk pemeliharaan," ujarnya.
Pemerintah
Lamteng berencana menaikkan anggaran infrastruktur 20% pada APBD 2012.
Ini didasarkan atas rencana pendapatan yang meningkat Rp200 miliar dari
Rp1,2 triliun menjadi Rp1,4 triliun dalam RAPBD 2012.
Sebelumnya,
sebagaimana diketahui, selama satu tahun kepemimpinannya, Bupati A.
Pairin menjelaskan pihaknya telah membangun jalan onderlaag
sepanjang 21,97 km. Selain itu, juga peningkatan jalan sepanjang 159,96
km dan pemeliharan jalan sepanjang 72,80 km.
"Pemkab
Lampung Tengah juga telah membangun 11 jembatan, talut sepanjang 485.92
M, 11 gorong-gorong, rehabilitasi, serta pemeliharaan sarana-prasarana
irigasi," ujar Pairin. (LUT/D-1)
9SUMBER:http://www.lampungpost.com/ruwa-jurai-aktual/lampung-tengah/16110-pendanaan--dprd-lamteng-usulkan-peningkatan-infrastruktur.html)
|
DIPA APBN Rp123,4 Miliar
”Penyaluran DIPA ini terlihat lebih cepat dibandingkan tahun
sebelumnya. Diharapkan, dengan disalurkannya DIPA ini, program yang
telah direncanakan dapat segera terealisasi,” ujar Wakil Walikota Metro
Saleh Chandra usai menghadiri penyerahan DIPA di Aula Pemkot Metro
kepada Radar Metro, kemarin (23/12).
Terpisah, Kepala Kantor Pelayanan Perbendaharaan Negara (KPPN) Kota Metro, Halistiana Trosarita menjelaskan, untuk DIPA di KPPN yang membawahi 3 wilayah daerah, seperti Kabupaten Lamteng, Lamtim, dan Kota Metro senilai Rp530,8 miliar. Jumlah ini mengalami kenaikan sebesar Rp12 miliar lebih dari pagu DIPA tahun 2011, yakni sebesar Rp518,8 miliar.
Selanjutnya, untuk DIPA kantor pusat dan instansi vertikal tersebut diberikan sebanyak 77 DIPA senilai Rp425,1 juta. Rinciannya, Kota Metro Rp123,4 miliar, Lamteng Rp152,8 miliar, dan Lamtim Rp148,8 miliar. Lalu, untuk tugas pembantuan SKPD senilai Rp29,7 miliar dengan rincian Kota Metro Rp1,6 miliar, Lamteng Rp11,8 miliar, dan Lamtim Rp16,1 miliar.
Kemudian, untuk DIPA urusan bersama senilai Rp75,2 miliar. Rinciannya, Metro Rp2,6 miliar, Lamteng Rp30,2 miliar, dan Lamtim Rp42,4 miliar, terangnya.
Sementara itu, untuk realisasi DIPA tahun 2011 pada triwulan ke III di wilayah Metro, Lamteng, dan Lamtim senilai Rp343,7 miliar atau sebesar 62%. Masing-masing terbagi dalam belanja pegawai Rp191,3 miliar atau 34%, belanja modal Rp11,5 miliar atau 2%, belanja barang Rp48,2 miliar atau 9%, dan belanja bantuan Rp92,3 miliar atau 17%. (ria/ayp)(sumber:http://www.radarlamteng.com/Sabtu, 24 Desember 2011 05:33:31)
Terpisah, Kepala Kantor Pelayanan Perbendaharaan Negara (KPPN) Kota Metro, Halistiana Trosarita menjelaskan, untuk DIPA di KPPN yang membawahi 3 wilayah daerah, seperti Kabupaten Lamteng, Lamtim, dan Kota Metro senilai Rp530,8 miliar. Jumlah ini mengalami kenaikan sebesar Rp12 miliar lebih dari pagu DIPA tahun 2011, yakni sebesar Rp518,8 miliar.
Selanjutnya, untuk DIPA kantor pusat dan instansi vertikal tersebut diberikan sebanyak 77 DIPA senilai Rp425,1 juta. Rinciannya, Kota Metro Rp123,4 miliar, Lamteng Rp152,8 miliar, dan Lamtim Rp148,8 miliar. Lalu, untuk tugas pembantuan SKPD senilai Rp29,7 miliar dengan rincian Kota Metro Rp1,6 miliar, Lamteng Rp11,8 miliar, dan Lamtim Rp16,1 miliar.
Kemudian, untuk DIPA urusan bersama senilai Rp75,2 miliar. Rinciannya, Metro Rp2,6 miliar, Lamteng Rp30,2 miliar, dan Lamtim Rp42,4 miliar, terangnya.
Sementara itu, untuk realisasi DIPA tahun 2011 pada triwulan ke III di wilayah Metro, Lamteng, dan Lamtim senilai Rp343,7 miliar atau sebesar 62%. Masing-masing terbagi dalam belanja pegawai Rp191,3 miliar atau 34%, belanja modal Rp11,5 miliar atau 2%, belanja barang Rp48,2 miliar atau 9%, dan belanja bantuan Rp92,3 miliar atau 17%. (ria/ayp)(sumber:http://www.radarlamteng.com/Sabtu, 24 Desember 2011 05:33:31)
pereaksi pembatas
Pereaksi Pembatas
Kata Kunci:
Pereaksi Pembatas
Ditulis oleh Budi Utami pada 13-08-2011
Di
dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang
ditambahkan tidak selalu sama dengan perbandingan koefisien reaksinya.
Hal ini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih
dahulu. Pereaksi demikian disebut pereaksi pembatas.Contoh:
1. Satu mol larutan natrium hidroksida (NaOH) direaksikan dengan 1 mol larutan asam sulfat (H2SO4) sesuai reaksi:
2 NaOH(aq) + H2SO4(aq) –> Na2SO4(aq) + 2 H2O(l)
Tentukan:
a. pereaksi pembatas
b. pereaksi yang sisa
c. mol Na2SO4 dan mol H2O yang dihasilkan
a. Mol masing-masing zat dibagi koefisien, kemudian pilih hasil bagi yang kecil sebagai pereaksi pembatas
mol NaOH/koefisien NaOH
=1/2 mol
= 0,5 mol
mol H2SO4/koefisien H2SO4
=1/1 mol
= 1 mol
Karena hasil bagi NaOH < H2SO4, maka NaOH adalah pereaksi pembatas, sehingga NaOH akan habis bereaksi lebih dahulu.

b. pereaksi yang sisa adalah H2SO4
c. mol Na2SO4 yang dihasilkan = 0,5 mol
mol H2O yang dihasilkan = 1 mol
2. 100 mL larutan Ca(OH)2 0,1 M direaksikan dengan 100 mL larutan HCl 0,1 M sesuai
reaksi:
Ca(OH)2(aq) + 2 HCl(aq) → CaCl2(aq) + 2 H2O(l)
Tentukan pereaksi pembatas!
Jawab:
mol Ca(OH)2 = M × V = 0,1 mol/liter × 0,1 liter = 0,01 mol
Karena hasil bagi mol mula-mula dengan koefisien pada HCl lebih kecil daripada Ca(OH)2, maka HCl merupakan pereaksi pembatas (habis bereaksi lebih dahulu).

Jadi, pereaksi pembatas adalah larutan HCl. (literatur: James E. Brady, 1990)
(sumber:http://www.chem-is-try.org/materi_kimia/kimia-sma-ma/pereaksi-pembatas/)
macam-macam konsentrasi
Macam-macam Konsentrasi
Ditulis oleh Utiya Azizah pada 06-03-2010
Konsentrasi
didefinisikan sebagai jumlah zat terlarut dalam setiap satuan larutan
atau pelarut. Pada umumnya konsentrasi dinyatakan dalam satuan fisik,
misalnya satuan berat atau satuan volume dan satuan kimia, misalnya mol,
massa rumus, dan ekivalen.1. Persen Konsentrasi
Dalam bidang kimia sering digunakan persen untuk menyatakan konsentrasi larutan. Persen konsentrasi dapat dinyatakan dengan persen berat (% W/W) dan persen volume (% V/V)Persen berat (% W/W)

Contoh Soal 5
a. Dalam 100 gram larutan terlarut 20 gram zat A. Berapa persen
berat zat A
b. Berapa persen volume zat B, bila dalam 50 mL larutan terlarut 10
mL zat B.
Penyelesaian

2. Parts Per Million (ppm) dan Parts Per Billion (ppb)
Bila larutan sangat encer digunakan satuan konsentrasi parts per million, ppm (bagian persejuta), dan parts per billion, ppb (bagian per milliar). Satu ppm ekivalen dengan 1 mg zat terlarut dalam 1 L larutan. Satu ppb ekivalen dengan 1 ug zat terlarut per 1 L larutan.
Parts per million (ppm) dan parts per billion (ppb) adalah satuan yang mirip persen berat. Bila persen berat, gram zat terlarut per 100 g larutan, maka ppm gram terlarut per sejuta gram larutan, dan ppb zat terlarut per milliar gram larutan.

3. Fraksi Mol
Fraksi mol (x) adalah perbandingan mol salah satu komponen dengan jumlah mol semua komponen. Jika suatu larutan mengandung zat A, dan B dengan jumlah mol masing-masing nA dan nB, maka fraksi mol masing-masing komponen adalah:
4. Molaritas (M)
Molaritas atau konsentrasi molar (M) suatu larutan menyatakan jumlah mol spesi zat terlarut dalam 1 liter larutan atau jumlah milimol dam 1 mL larutan.
(sumber:http://www.chem-is-try.org/materi_kimia/kimia_dasar/asam_dan_basa/macam-macam-konsentrasi/)
penggolongan dan identifikasi karbohidrat
Karbohidrat merupakan polimer alami
yang dihasilkan oleh tumbuh-tumbuhan dan sangat dibutuhkan oleh manusia
dan hewan. Karbohidrat juga merupakan sumber energi yang terdiri atas
unsur-unusr C, O, dan H dengan rumus molekul Cn(H2O)n.
Pada senyawa karbohidrat terdapat berbaga gugus fungsi yang diikatnya
yaitu gugus fungsi keton, aldehid, dan gugus hidroksi.
Glukosa dapat diperoleh dari hidrolisis sukrosa (gula tebu) atau pati (amilum). Di alam glukosa terdapat dalam buah-buahan dan madu lebah. Dalam alam glukosa dihasilkan dari reaksi antara karbondioksida dan air dengan bantuan sinar matahari dan klorofil dalam daun serta mempunyai sifat:
Fruktosa adalah suatu ketoheksosa yang mempunyai sifat memutar cahaya terpolarisasi ke kiri dan karenanya disebut juga levulosa. Fruktosa mempunyai rasa lebih manis dari pada gula tebu atau sukrosa. Fruktosa dapat dibedakan dari glukosa dengan pereaksi seliwanoff, yaitu larutan resorsinol (1,3 dhidroksi-benzena) dalam asam clorida. Disebut juga sebagai gula buah, dperoleh dari hdrolisis sukrosa; dan mempunyai sifat:
Umumnya berikatan dengan glukosa dalam bentuk laktosa, yaitu gula yang terdapat dalam susu. Galaktosa mempunyai sifat memutar bidang cahaya terpolarisasi ke kanan. Pada proses oksidasi oleh asam nitrat pekat dan dalam keadaan panas galaktosa menghasilkan asam musat yang kurang larut dalam air bila dibandingkan dengan asam sakarat yang dihasilkan oleh oksidasi glukosa. Dapat diperoleh dari hidrolisis gula susu (laktosa), dan mempunyai sifat:
Beberapa sifat lakotsa:
Ditinjau dari gugus fungsi yang diikat:
- Aldosa: karbohidrat yang mengikat gugus aldehid. Contoh: glukosa, galaktosa, ribosa
- Ketosa: karbohdrat yang mengikat gugus keton. Contoh: fruktosa
Ditinjau dari hasil hidrolisisnya:
- Monosakarida: karbohidrat yang tidak dapat dihidrolisis menjadi molekul-molekul karbohidrat yang lebih sederhana lagi. Misalnya: glukosa, fruktosa, ribosa, galaktosa
- Disakarida: karbohidrat yang terbentuk dari kondensasi 2 molekul monosakarida. Misalnya: sukrosa (gula tebu), laktosa (gula susu), dan maltosa (gula pati)
- Oligosakarida: karbohidrat yang jika dihidrolisis akan terurai menghasilkan 3 – 10 monosakarida, misalnya dekstrin dan maltopentosa
- Polisakarida: karbohirdat yang terbentuk dari banyak molekul monosakarida. Misalnya pati (amilum), selulosa, dan glikogen.
Beberapa monosakarida penting sebagai berikut.
1. Glukosa
Glukosa dapat diperoleh dari hidrolisis sukrosa (gula tebu) atau pati (amilum). Di alam glukosa terdapat dalam buah-buahan dan madu lebah. Dalam alam glukosa dihasilkan dari reaksi antara karbondioksida dan air dengan bantuan sinar matahari dan klorofil dalam daun serta mempunyai sifat:
- Memutar bidang polarisasi cahaya ke kanan (+52.70)
- Dapat mereduksi larutan fehling dan membuat larutan merah bata
- Dapat mengalami mutarotasiDapat difermentasi menghasilkan alkohol (etanol) dengan reaksi sebagai berikut:
C6H12O6
--> 2C2H5OH + 2CO2
2. Fruktosa
Fruktosa adalah suatu ketoheksosa yang mempunyai sifat memutar cahaya terpolarisasi ke kiri dan karenanya disebut juga levulosa. Fruktosa mempunyai rasa lebih manis dari pada gula tebu atau sukrosa. Fruktosa dapat dibedakan dari glukosa dengan pereaksi seliwanoff, yaitu larutan resorsinol (1,3 dhidroksi-benzena) dalam asam clorida. Disebut juga sebagai gula buah, dperoleh dari hdrolisis sukrosa; dan mempunyai sifat:
- Memutar bidang polarisasi cahaya ke kiri (-92.4oC)
- Dapat mereuksi larutan fehling dan membentuk endapan merah bat
- Dapat difermentasi
3. Galaktosa
Umumnya berikatan dengan glukosa dalam bentuk laktosa, yaitu gula yang terdapat dalam susu. Galaktosa mempunyai sifat memutar bidang cahaya terpolarisasi ke kanan. Pada proses oksidasi oleh asam nitrat pekat dan dalam keadaan panas galaktosa menghasilkan asam musat yang kurang larut dalam air bila dibandingkan dengan asam sakarat yang dihasilkan oleh oksidasi glukosa. Dapat diperoleh dari hidrolisis gula susu (laktosa), dan mempunyai sifat:
- Dapat mereduksi larutan fehling membentuk endapan merah bata
- Tidak dapat difermentasi
Beberapa disakarida penting sebagai berikut.
1. Laktosa
Laktosa memiliki gugus karbonil yang berpotensi bebas pada residu glukosa. Laktosa adalah disakarida pereduksi. Selama proses pencernaan, laktosa mengalami proses hidrolisis enzimatik oleh laktase dari sel-sel mukosa usus.Beberapa sifat lakotsa:
- Hidrolisis laktosa menghasilkan molekul glukosa dan galaktosa
- Hanya terdapat pada binatang mamalia dan manusia
- Dapat dperoleh dari hasil samping pembuatan keju
- Bereaksi positif terhadap pereaksi fehling, benedict, dan tollens
2. Maltosa
Beberapa sifat maltosa:- Hidrolisis maltosa menghasilkan 2 molekul glukosa
- Digunakan dalam makanan bayi dan susu bubuk beragi (malted milk)
- Bereaksi positif terhadap pereaksi fehling, benedict, dan tollens
3. Sukrosa
Sukrosa atau gula tebu adalah disakarida dari glukosa dan fruktosa. Sukrosa dibentuk oleh banyak tanaman tetapi tidak terdapat pada hewan tingkat tinggi. Sukrosa mempunyai sifat memutar cahaya terpolarisasi ke kanan. Hasil yang diperoleh dari reaksi hidrolisis adalah glukosa dan fruktosa dalam jumlah yang ekuimolekular. Sukrosa bereaks negatif terhadap pereaksi fehling, benedict, dan tollens.Beberapa polisakarida penting.
1. Selulosa
- Merupakan komponen utama penyusun serat dinding sel tumbuhan
- Polimer dari glukosa
- Hirolisis lengkap dengan katalis asam dan enzim akan menghasilkan glukosa
2. Pati atau amilum
- Polimer dari glukosa
- Apabila dilarutkan dalam air panas, pati dapat dipisahkan menjadi amilosa dan amilopektin
- Amilopektin merupakan polimer yang lebih besar dari amilosa
- Hirdolisis parsial akan menghasilkan amilosa
- Hidrolisis lengkap akan menghasilkan glukosa
3. Glikogen
- Hidrolisis glikogen akan menghasilkan glukosa
- Dalam sistem hewan, glikogen digunakan sebagai cadangan makanan (glukosa)
4. Kitin
- Bangungan utama dari hewan beraki banyak seperti kepiting
- Merupakan polimer dari glukosamina
- Hidrolisis akan menghasilkan 2-amino-2-deoksi-glukosa
Analisa kualiatif karbohidrat.
1. Uji Molisch
- Prinsip reaksi ini adalah dehidrasi senyawa karbohidrat oleh asam sulfat pekat.
- Dehidrasi heksosa menghasilkan senyawa hidroksi metil furfural, sedangkan dehidrasi pentosa menghasilkan senyawa fulfural.
- Uji positif jika timbul cincin merah ungu yang merupakan kondensasi antara furfural atau hidroksimetil furfural dengan alpha-naftol dalam pereaksi molish.
2. Uji Seliwanoff
- Merupakan uji spesifik untuk karbohidrat yang mengandung gugus keton atau disebut juga ketosa
- Jika dipanaskan karbohidrat yang mengandung gugus keton akan menghasikan warna merah pada larutannya.
3. Uji Benedict
- Merupakan uji umum untuk karbohidrat yang memiliki gugus aldehid atau keton bebas
- Uji benedict berdasarkan reduksi Cu2+ menjadi Cu+ oleh gugus aldehid atau keton bebas dalam suasana alkalis
- Biasanya ditambahkan zat pengompleks seperti sitrat atau tatrat untuk mencegah terjadinya pengendapan CuCO3
- Uji positif ditandai dengan terbentuknya larutan hijau, merah, orange atau merah bata serta adanya endapan.
4. Uji Barfoed
- Digunakan untuk menunjukkan adanya monosakarida dalam sampel
- Uji positif ditunjukkan dengan terbentuknya endapan merah orange
5. Uji Iodin
- Digunakan untuk menunjukkan adanya polisakarida
- Amilum dengan iodine dapat membentuk kompleks biru
- Amilopektin dengan iodin akan memberi warna merah ungu
- sedangkan dengan glikogen dan dekstrin akan membentuk warna merah coklat
6. Uji Fehling
- Digunakan untuk menunjukkan adanya karbohidrat pereduksi (monosakarida, laktosa, maltosa, dll)
- Uji positif ditandai dengan warna merah bata (sumber:http://jejaringkimia.blogspot.com/2010/03/karbohidrat.html)
Langganan:
Komentar (Atom)

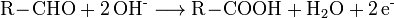


 Rencana
Ukuran Jembatan Selat Sunda
Rencana
Ukuran Jembatan Selat Sunda








